纯物质水的相图
除了用计算组分逸度和活度的方法外,相平衡研究还可通过制作相图的方法来实现。这种方法是以![]() 相律作指导,所不同的是,它不是用计算的方法来描述,而是用图示的方法来展示相平衡的规律,因此别具一格。本专题旨在讨论最简单的纯物质水的平衡相图。
相律作指导,所不同的是,它不是用计算的方法来描述,而是用图示的方法来展示相平衡的规律,因此别具一格。本专题旨在讨论最简单的纯物质水的平衡相图。
1. 相律分析
对于单组分系统,![]() 相律可表示为
相律可表示为
![]() (21-1)
(21-1)
由于这个系统至少有一个相,故自由度最多等于2,也就是说,在一定范围内自由变化而不致引起旧相消失和新相形成的独立强度性质数最多有2个。所以,构作单组分系统的相图只需要2个坐标。又因这个系统无浓度可言,两个坐标只能是压力和温度,故单组分系统的相图便是它的![]() 图。
图。
由式(21-1)可知,当系统单相存在时,![]() ,此时在相图中是一个面;当系统两相共存时,
,此时在相图中是一个面;当系统两相共存时,![]() ,此时在相图中是一条线;当系统三相共存时,
,此时在相图中是一条线;当系统三相共存时,![]() ,在相图中则是一个温度和压力都指定的点,这个点称为三相点,它可以是气、液、固三相共存,也可以是固、液、固或固、固、固三相共存。但相律指出,四相共存是不可能的,因为此时
,在相图中则是一个温度和压力都指定的点,这个点称为三相点,它可以是气、液、固三相共存,也可以是固、液、固或固、固、固三相共存。但相律指出,四相共存是不可能的,因为此时![]() ,这是不允许的。
,这是不允许的。
2. 纯物质的pVT图和相图
图21-2 纯物质的相图 图21-1 纯物质的pVT图
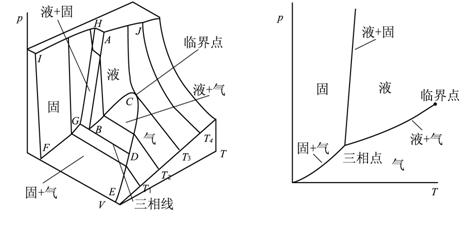
纯物质的压力、体积和温度是可以实验测定的,而且已经积累了许多物质的pVT数据。如果将这些数据作成pVT图,则大多数物质有如图21-1所示的图形。这是一个复杂的图形,主要由五个光滑的曲面构成:曲面BCD是液体和气体的共存区;曲面DEFG是固体和气体共存区;曲面GHAB是固体和液体共存区。这三个曲面都垂直于pT平面,而且相交于直线GBD,这条线称为三相线。其中G点代表固相,B点代表液相,D点代表气相,显然,三相线也垂直于pT平面。另外两个曲面是FGHI和ABCDE右上侧的曲面,前者是固体区域,后者是液体区域和气体区域,其中以临界等温线JC为界,ABCJ面代表液体,其他区域代表气体,它们同在一个光滑的曲面上。
现将这个图形向pT平面投影,即得到相图,就像图21-2所示。上述三个垂直于![]() 平面的曲面变成了三条曲线,它们相交于一点,这点便是三相线的投影,故称三相点,三条曲线则分别称为气液、气固和液固平衡曲线。它们将相图划分成三个区域,这三个区域分别为气、液、固单相区域。应该指出,气固和液固平衡曲线从三相点出发是可以向外延伸的,但气液平衡曲线不能,它中止于临界点,因为到了临界点,气相和液相便难以区分。
平面的曲面变成了三条曲线,它们相交于一点,这点便是三相线的投影,故称三相点,三条曲线则分别称为气液、气固和液固平衡曲线。它们将相图划分成三个区域,这三个区域分别为气、液、固单相区域。应该指出,气固和液固平衡曲线从三相点出发是可以向外延伸的,但气液平衡曲线不能,它中止于临界点,因为到了临界点,气相和液相便难以区分。
3. 水的相图
上面已述,大多数物质的pVT图如图21-1所示,但水和少数物质不在其列,水的pVT图,有如图21-3所示形状。
图21-3 水的pVT图 图21-4 水的相图
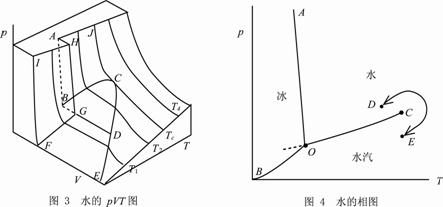
它也由类似于图21-1的五个光滑曲面构成。所不同的是,水的固体和液体共存区GHAB被遮住了,在图21-3中只能用虚线表示。三相线为BGD,代表固相的G点在B点(液相)和D点(气相)之间,这说明一定质量的冰的体积大于水的体积,冰熔化成水时体积减小。专题13已述,纯物质的一级相变都遵守Clapeyron方程,由
![]() (21-2)
(21-2)
可知,水的液固平衡曲线OA的斜率是负的。因为式中![]() 是
是![]() 冰的摩尔熔化焓,
冰的摩尔熔化焓,
由于熔化是吸热的,其值大于零。而![]() 和
和![]() 分别为H2O(l)和 H2O(s)的摩尔体积,两
分别为H2O(l)和 H2O(s)的摩尔体积,两
者之差小于零,故![]() 。
。
水有完备的pVT实验数据,它的三条平衡曲线可分别由表21-1、表21-2和表21-3表示。
气液平衡曲线OC:
表21-1 水的饱和蒸气压
|
t / ºC |
-15 |
-10 |
-5 |
0.01 |
20 |
100 |
374.15 |
|
|
190.5 |
285.7 |
421.0 |
610.5 |
2337.8 |
101325 |
22.12×106 |
表中最后一列分别为水的临界温度和临界压力,表列数据到此为止,不能继续延伸。但这条平衡曲线却可向另一端延伸,就像图21-4中虚线所示。它表示水在低于三相点时仍能以过冷液态存在,依然保持气液平衡状态,这种平衡称为介稳平衡。它是由于新相冰的形成困难所致,在专题39中将作更详细的讨论。一旦在过冷水中加入少量冰作为晶种,水便立即结冰。
气固平衡曲线OB:
表21-2 冰的饱和蒸气压
|
t / ºC |
-30 |
-25 |
-20 |
-15 |
-10 |
-5 |
0.01 |
|
|
38.1 |
63.5 |
103.5 |
165.5 |
260.0 |
401.7 |
610.5 |
与表21-1列出的数据比较,可见在同温度下,冰的饱和蒸气压比过冷水的饱和蒸气压低。表明曲线OB的斜率大于同温度下曲线OC的斜率,这是由于H2O(s)的摩尔升华焓![]() 大于H2O(l)的摩尔蒸发焓
大于H2O(l)的摩尔蒸发焓![]() 之故。
之故。
液固平衡曲线OA:
表21-3 水的凝固点
|
|
610.5 |
101325 |
59.8×106 |
110.4×106 |
156.0×106 |
193.5×106 |
|
t / ºC |
0.01 |
0.0025 |
-5.0 |
-10.0 |
-15.0 |
-20.0 |
由表21-3列出的数据可见,这条平衡曲线不但有负的斜率,而且很陡。要使水的凝固点降低到-![]() 虽小于
虽小于![]() ,但两者相差很小,故由式(21-2)可得
,但两者相差很小,故由式(21-2)可得![]() 的绝对值很大。
的绝对值很大。
4. 水的三相点
三相线BGD在pT平面上的投影是点O,称为水的三相点,它是上述三条平衡曲线的交点,在这个点上,气、液、固三相共存,这样的点在图21-4中是惟一的。自从1854年Kelvin提出可用一个固定点的温度值来定义热力学温标后,人们几乎经过了一个世纪的努力,终于找到了水的三相点温度值是定义热力学温标最理想的值,因为热力学证明,这个温度极为稳定。为此,人们设计了图21-5所示的测定装置——水的三相点瓶*:
图21-5 水的三相点测定装置![]()
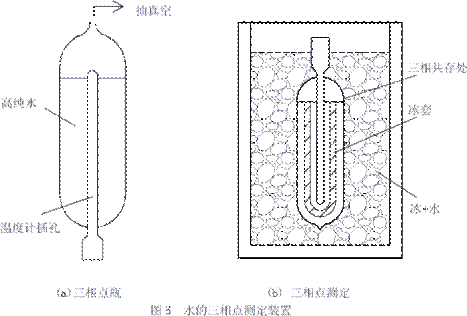
在一个用优质玻璃制成的水的三相点瓶中,放入高纯度的水,就像图21-5(a)所示。将水加热并接入抽真空系统,溶解在水中的空气和CO2便可去除,然后,将抽真空的口用火焰封死。此时,瓶中的水只有二相,即水和饱和水蒸汽,怎样获得第三相冰呢?将瓶倒过来,在温度计插孔处加入冰和盐的混合物,便可在温度计插孔的周围结上一层冰,再改用水加入温度计的插孔,冰层就与插孔分开,形成悬于水中的环状冰套。于是,像图21-5(b)中所示,出现了固、液、气三相共存处,该点测得的温度,即为水的三相点温度。为使测定结果稳定,可将三相点瓶放入有冰水混合物的容器中,就像图21-5(b)所示,这样,冰套可保持几个月不化。
在水的三相点准确测定上,我国物理化学家、北京大学黄子卿教授曾作过杰出的贡献。早在1938年,他和他的同事们精心设计和反复测量,得到了当时最精确的结果:
![]() ℃
℃
并被国际上所接受。这一结果直到1949年,才被更精确结果所取代。1954年,第十届国际计量大会正式决定采用水的三相点来定义热力学温标,并给定水的三相点温度值为+
应该指出,三相点不同于通常说的冰点。冰点是指空气压力为101325Pa时,水与冰的平衡温度。由表21-3可见,当压力为101325Pa时,水的凝固点为![]() 和
和![]() 。已知空气的组成是N2为79%,O2为21%,水的凝固点下降常数为
。已知空气的组成是N2为79%,O2为21%,水的凝固点下降常数为![]() ,故可算得凝固点下降为:
,故可算得凝固点下降为:
![]()
这就是说,水的冰点当为![]() ℃
℃![]() ℃。这与众所周知的
℃。这与众所周知的
5. 水的临界点
在水的相图(图21-4)中,还有一个特殊的点C,称为临界点,就像三相点一样,它也有确定的温度和压力,它是气液平衡曲线OC的终点。将水沿着OC曲线升温时,饱和蒸气压随之增高,但平衡的气液两相密度却愈来愈接近。当接近临界点时,系统变得浑浊而呈现一片乳白色,此称“临界乳光”,是由于光的散射增强所致。精确的测量表明,当达临界点时,两相密度相等,蒸发焓等于零。这时气相与液相已不可分辨,既不能说气相变成了液相,也不能说液相变成了气相,而是合二为一了。
鉴于图21-1和图21-3中ABCDE右上侧是一片光滑的曲面,其中ABCJ代表液相区域,其余代表气相,故气液两相是可以连续转变的,正如水的相图(图21-4)中箭头所示的途径,由点D到点E,或是反之,便可实现两相间的连续转变,而不经过任何相的突变点。
此外,由于临界点上气液两相合二为一,故不同于三相点,系统在该点只有一个相,那末,相律是否适用呢?按照式(21-1),它的自由度应等于2,这显然是不可能的。因为临界点也有确定的温度和压力。对于水,已知![]() ,
,![]() ,是没有自由度的。应该指出临界点是个特殊的点,在该点处,Clapeyron方程已不再适用,因为据此算得的
,是没有自由度的。应该指出临界点是个特殊的点,在该点处,Clapeyron方程已不再适用,因为据此算得的![]() 是个不定值。可是,根据纯物质气液平衡的稳定性原理**,该点必须满足如下条件:
是个不定值。可是,根据纯物质气液平衡的稳定性原理**,该点必须满足如下条件:
![]() ,
, ![]() ,
, ![]() (21-3)
(21-3)
如果纯物质的状态方程已知,则由式(21-3)中的两个等式可以转变成两个![]() 与
与![]() 间的关系式,这是系统强度性质间的两个独立的关系式。由于它们既非离子间的电中性条件,又非化学反应计量关系所致,因此,是两个“附加”或“额外”的限制条件。如同恒沸点一样,其相律可表示为*
间的关系式,这是系统强度性质间的两个独立的关系式。由于它们既非离子间的电中性条件,又非化学反应计量关系所致,因此,是两个“附加”或“额外”的限制条件。如同恒沸点一样,其相律可表示为*
![]() (21-4)
(21-4)
式中![]() 为组分数,
为组分数,![]() 为“附加”的限制条件数。这就是说,
为“附加”的限制条件数。这就是说,![]() 不同于
不同于![]() ,它只影响系统的自由度,而不影响系统的独立组分数。对于临界点,
,它只影响系统的自由度,而不影响系统的独立组分数。对于临界点,![]() =2,故
=2,故
![]()
6. 水的高压相图
图21-4只是水在低压下的相图,其实,在高压下,水的相图是非常复杂的。上世纪初,Bridgman(布里治曼)等在研究很高压力下水的冰冻时,又发现了若干冰的新形态,分别称为冰Ⅱ,冰Ⅲ,冰Ⅴ,冰Ⅵ和冰Ⅶ。还有冰Ⅳ和冰Ⅷ则发现是不稳定的,甚至它们是否存在,至今仍有争议。因此,水总共有七个三相点,就像表21-4所列,其中冰I即为普通的冰。
表21-4 水的三相点
|
平衡三相 |
T / K |
p / Pa |
|
冰I——水——水汽 |
273.16 |
610.5 |
|
冰I——水——冰Ⅲ |
251.15 |
2.075×108 |
|
冰I——冰Ⅱ——冰Ⅲ |
238.45 |
2.129×108 |
|
冰Ⅱ——冰Ⅲ——冰Ⅴ |
248.85 |
3.443×108 |
|
冰Ⅲ——水——冰Ⅴ |
256.15 |
3.463×108 |
|
冰Ⅴ——水——冰Ⅵ |
273.31 |
6.258×108 |
|
冰Ⅵ——水——冰Ⅶ |
354.75 |
2.197×109 |
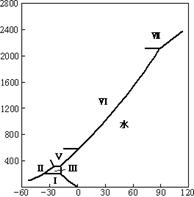
t /℃
![]()
图21-6 水的高压相图
图21-6是高压下水的相图,图中的三相点即如表21-4数据所列,至于高压下的冰究竟会有多少种,迄今还不完全清楚。
参考资料
[1] 于渌,郝柏林.相变和临界现象.北京:科学出版社,1984
[2] Zemansky M W,Dittman R H.热学和热力学(第六版).刘皇风等译.北京:科学出版社
1987
注: 该拓展材料选自:刘国杰,黑恩成编著科学版名师导读系列丛书《物理化学导读》(2008年1月,科学出版社出版)。